- Клинические исследования (КИ)
- Участие в клинических исследованиях
- Регистрация медицинских изделий
- Фармаконадзор
- Доклинические исследования (ДИ)
- Исследования биоэквивалентности (КИ БЭ)
- Регистрация лекарственных средств
- Научные обзоры
- Консультирование и поддержка
- Разработка новых лекарственных препаратов
Клинические исследования (КИ)
Компания ЭР ЭНД ДИ ФАРМА проводит все виды клинических исследований для воспроизведенных, гибридных, а также оригинальных (референтных) лекарственных препаратов.
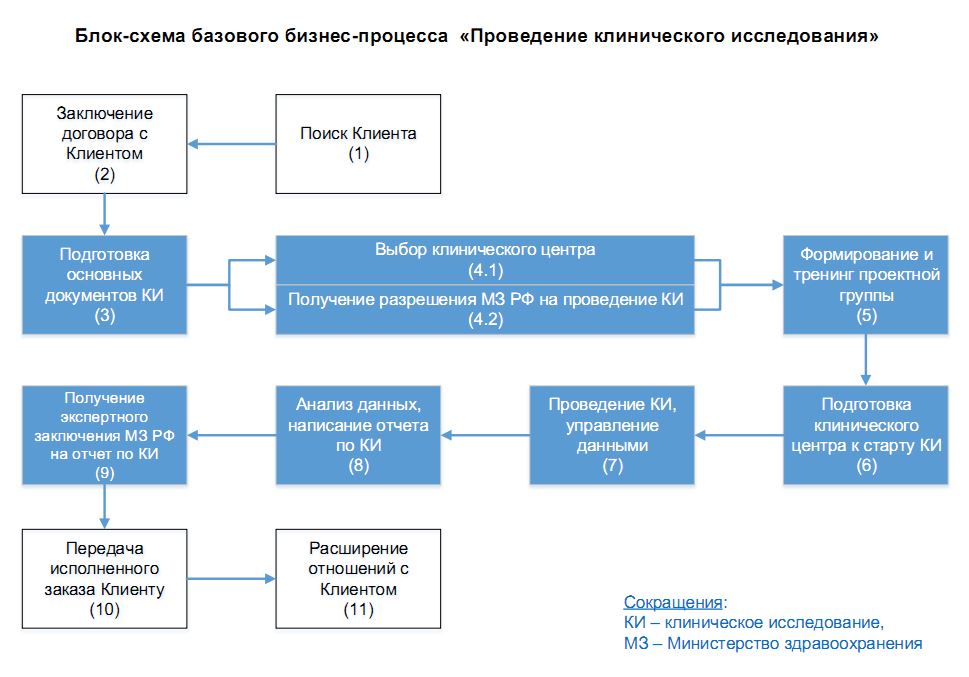
Действующий регламентированный процесс проведения клинического исследования в Компании, представлен на блок-схеме:
- выбору и предварительной подготовке каждого клинического центра к старту исследования;
- логистике и хранению исследуемых препаратов;
- управлению данными и их анализу;
- конфиденциальности при проведении работ.
При необходимости, Компания получает заключение от внешнего консультанта экспертного уровня на каждый ключевой документ, разрабатываемый для проведения или формируемый по результатам проведенного клинического исследования.
- ФЗ РФ от 12.04.2010г N 61-ФЗ «Об обращении лекарственных средств»;
- Национальный стандарт Российской Федерации ГОСТ 52379-2005 «Надлежащая клиническая практика»;
- Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. N 200н "Об утверждении правил надлежащей клинической практики";
- Постановление Правительства Российской Федерации от 13 сентября 2010 г. N 714 «Об утверждении типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата»;
- Постановление Правительства Российской Федерации от 3 сентября 2010 г. N 683 «Об утверждении правил аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов»;
- Руководство по проведению клинических исследований лекарственных средств. Часть первая. – М.:Гриф и К, 2012;
- Руководство по проведению клинических исследований лекарственных средств. Часть вторая. – М.:Гриф и К, 2012.
Однако нашим Партнерам мы рекомендуем принимать в расчет и документы, подготовленные в рамках «Соглашения о единых принципах и правилах обращения лекарственных средств, в рамках Евразийского экономического союза».
При планировании клинических исследований и непосредственно разработке Протокола, мы используем актуальные требования и рекомендации ICH, EMA и FDA с целью поддержания проводимых нами исследований на должном научном и доказательном уровнях, особенно в тех случаях, когда необходимые для исследования методологические подходы еще не отражены в нормативно-правовых документах РФ.
Свой запрос по клиническому исследованию отправляйте, пожалуйста, на адрес info@rdpharma.ru.